水解和电离的区别,考虑电离还是水解?
时间: 2024-09-11 08:30:48 100浏览
一、根据题目给定的溶液酸碱性信息判断
例一:0.2mol/L的CH3COOH与0.1mol/L的NaOH等体积混合,反应后溶液呈酸性。
分析:反应后溶液组成是等量的CH3COOH与CH3COONa混合,因为溶液呈酸性。所以考虑CH3COOH的电离程度大于CH3COONa水解(忽略不计)。
二、根据溶液中电荷守恒进行判断
例二、CH3COOH与CH3COONa混合溶液中,若已知c(CH3COO-) > c(Na+),则根据电荷守恒可推出c(H+)>c(OH-),溶液显酸性。考虑CH3COOH的电离程度大于CH3COONa水解(忽略不计)。
三、通过图像分析,
例三、常温下,用0.100mol/L盐酸滴定20mL 0.100mol/L氨水,溶液pH随加入盐酸体积变化如图所示,
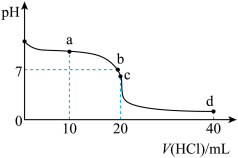
a点溶质为等量的氯化铵和氨水,此时通过纵坐标判断溶液显碱性,氨水电离程度大于铵根离子水解程度,所以a点浓度:c(NH4+)>c(Cl-) > c(NH3.H2O)
四、通过计算Ka与Kh,比较大小判断
例四、常温下,向20mL 0.1mol/LNaB溶液中滴入等浓度的HA溶液,所得溶液中 c(A-)/c(B-)
与lgc(HA)/c(HB) 的关系如图所示。已知Ka(HA)=1.6x10-4。
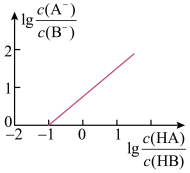
求滴入20mL HA溶液后:c(B-)与c(HA)大小
分析:由图Ka(HA)=1.6×10-4,则Ka(HB)=1.6×10-5。滴入20mLHA溶液后,NaB与HA恰好反应得到等物质的量浓度NaA和HB混合溶液,NaA微弱水解,HB微弱电离,由于Ka(HA)=1.6×10-4,则Kh(HA)=Kw/Ka < Ka(HB)=1.6×10-5,可推知HB电离程度大于NaA水解程度,则混合溶液成酸性,所以c(B-)>c(HA)。

